Nineļa Miriama Vainšeļbauma ir LU bioloģijas doktorantūras studiju programmas 2. kursa studente un LU fonda stipendijas LU doktorantūras studentiem dabaszinātņu, medicīnas un dzīvības zinātņu jomā saņēmēja. Jaunās pētnieces promocijas darbs tiek izstrādāts Latvijas Biomedicīnas pētījumu un studiju centra (BMC) Vēža šūnu bioloģijas un melanomas izpētes grupā; darbu vada Dr. habil. med. Jekaterina Ērenpreisa.
Pērnā gada nogalē žurnālā “International Journal of Molecular Sciences” tika nopublicēts vēža šūnu izpētei veltīts zinātnisks raksts “Phylostratic Shift of Whole-Genome Duplications in Normal Mammalian Tissues towards Unicellularity Is Driven by Developmental Bivalent Genes and Reveals a Link to Cancer”, BMC zinātniekiem sadarbojoties ar ārzemju kolēģiem. Nineļa Miriama Vainšeļbauma ir šī raksta līdzautore.
Raksta pamatā ir bioinformātisks pētījums, kas ietver poliploīdo (vairāk nekā 2 hromosomu komplektus saturošo) un diploīdo (2 hromosomu komplektus saturošo) cilvēka un peles normālo audu (sirds un aknu) gēnu ekspresijas salīdzinājumu jeb šķērssugu diferenciālās gēnu ekspresijas analīzi. Diferenciāli ekspresētie gēni turpmāk tika analizēti, pielietojot daudzveidīgu bioinformātisko, statistisko un sistēmu bioloģijas metožu klāstu, lai precīzi noteiktu, kādi molekulārie signālceļi un bioloģiskie procesi maina savu aktivitāti un savstarpējo mijiedarbību, palielinoties šūnu ploīdijai. Jaunās pētnieces ieguldījums pētījumā galvenokārt saistīts ar bivalento gēnu un to filostrātu izpēti.
Nineļsa Miriamas Vainšeļbaumas promocijas pētījuma plāns veltīts ļaundabīgo audzēju ploīdijas izmaiņu (it īpaši triploīdijas, kas saistīta ar paaugstinātu slimības agresivitāti un rezistenci pret terapiju) izpētei. Lasītājam var rasties jautājums – kā šis darbs ar normāliem, ļaundabīgās transformācijas neskartiem audiem varētu būt saistīts ar vēzi?
Vēža šūnām, it īpaši visnopietnākajā, metastātiskajā slimības stadijā, piemīt unikālās evolucionārās adaptācijas spējas, kas ļauj slimībai atgriezties pēc ārstēšanas – pielietojot, piemēram, ķīmijterapiju vai radioterapiju, neliela vēža šūnu populācija bieži pielāgojas, izdzīvo un atjauno audzēju. Pētījumu rezultāti liecina, ka šīs adaptācijas ietver poliploīdiju, cilmes šūnām līdzīgā fenotipa iegūšanu, pseido-mejozi (bezdzimum- un dzimumvairošanas procesiem līdzīgas īpašības), kā arī atavistisko regresiju (daudzšūņu gēnu ekspresijas nomākšanu un senāko vienšūņu gēnu aktivāciju).
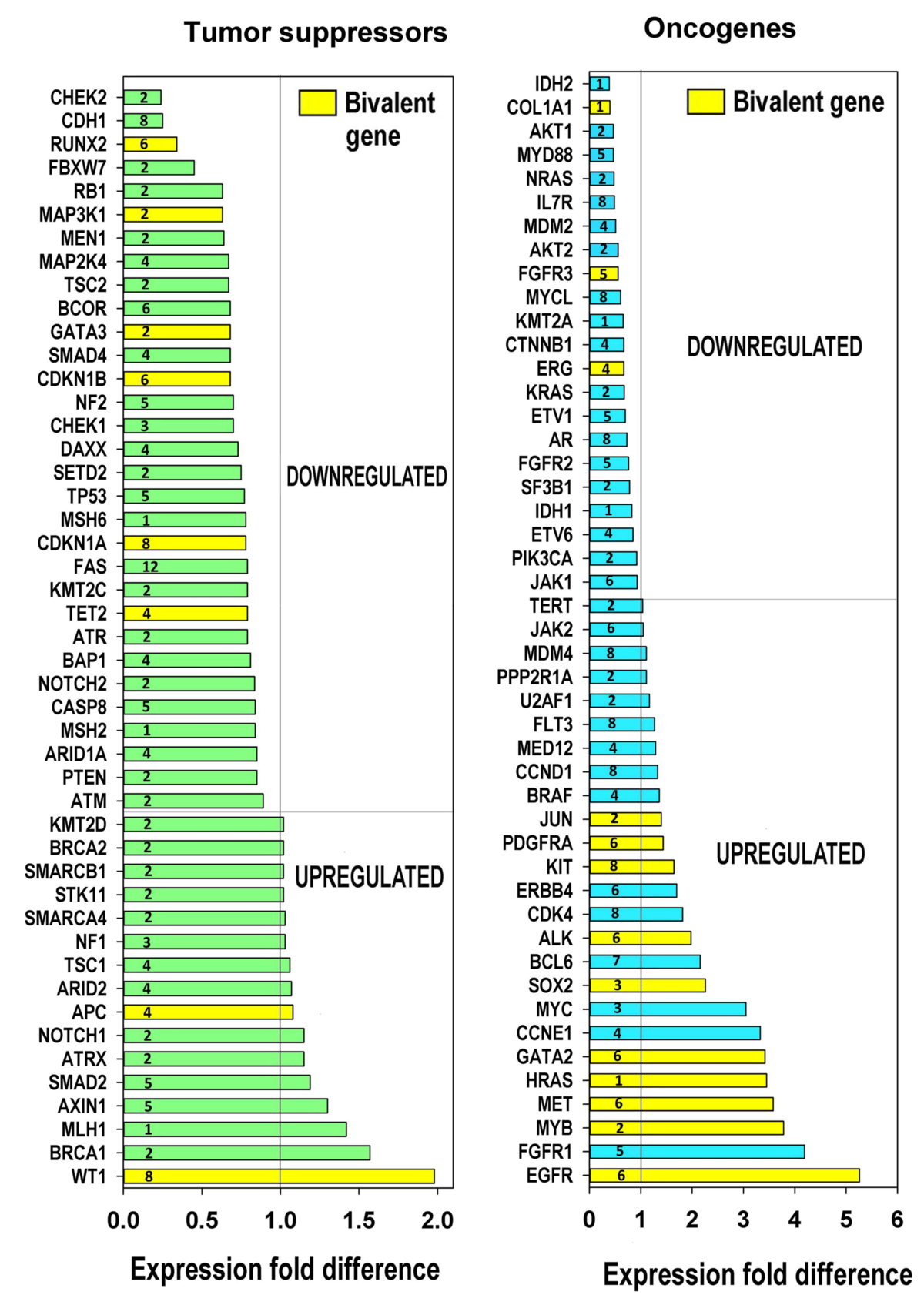
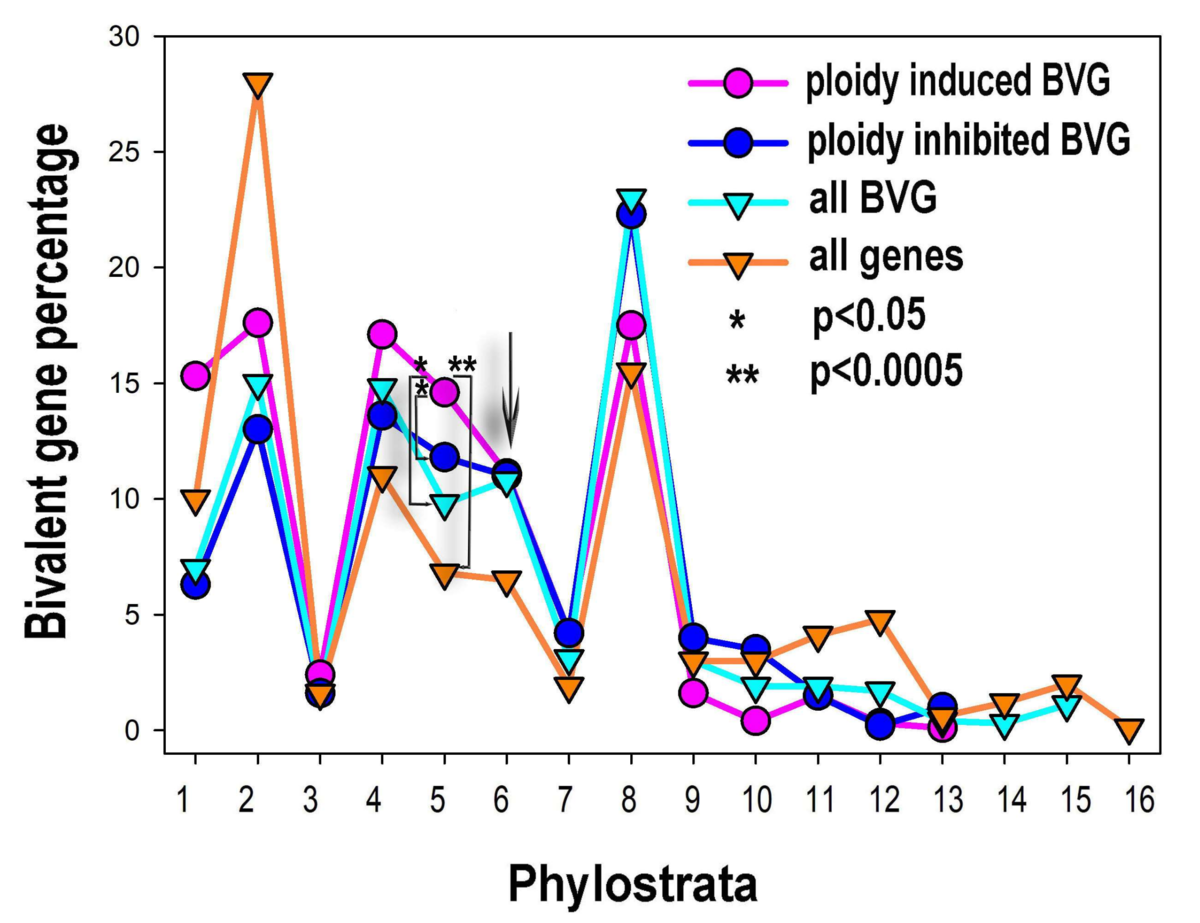
Salīdzinot normālus diploīdos audus ar poliploīdajiem, tika novērots, ka poliploīdo šūnu transkriptomos ekspresējas lielāks gēnu daudzumsar senāku (vienšūņu vai seno daudzšūņu) evolucionāru izcelsmi, bet gēni no evolucionāri vēlīnām formām tiek supresēti. Turklāt daudzi no poliploīdajos audos up-regulētajiem (gēns, kura ekspresija ir paaugstināta noteiktos apstākļos, piemēram, vēža šūnā salīdzinot ar normālo šūnu) senajiem gēniem ir attīstības procesos iesaistītie bivalentie gēni. Bivalence ir gan represējošo, gan aktivējošo hromatīna modifikāciju klātbūtne, kas dod gēnam iespēju strauji mainīt aktivitāti un, attiecīgi, arī šūnas likteni (fenotipu). Beidzot, neskatoties uz to, ka poliploīdie audi nekādā mērā nebija transformēti, tajos tika novērota proto-onkogēnu up-regulācija un audzēju supresoru gēnu aktivitātes nomākšana.
Augšminētie novērojumi ir svarīgi, jo tie iezīmē poliploīdijas izšķirošo lomu vēža dzīvotspējā un rezistencē pret terapiju – pat pilnīgi normālos audos, bez genoma nestabilitātes un plašām mutācijām, kas raksturīgi vēža šūnām, poliploīdija spēj radīt ģenētiskos un epiģenētiskos apstākļus, kas evolucionāri labvēlīgi audzēju adaptācijai pret iznīcināšanu. Turklāt tas, ka bivalento attīstības gēnu, kas aktīvi mijiedarbojas ar c-myc proto-onkogēnu (kas ir šūnu reprogrammēšanas „karalis”), ekspresija virza poliploīdo normālo audu transkriptomu uz vienšūņu pusi, norāda uz šī procesa potenciālo iesaisti arī vēža atavistiskajā regresijā un epiģenētiskajā reprogrammēšana.
Balstoties uz šiem aizraujošajiem rezultātiem, darbs pašlaik tiek turpināts, salīdzinot gēnu ekspresiju ļaundabīgajos audzējos no “The Cancer Genome Atlas” datubāzes (kopumā 13 vēža veidi) ar to pašu pacientu normālo audu paraugiem un mēģinot integrēt normālo audu izpētes rezultātus ar zināšanām par audzējiem raksturīgo pseido-mejozi. Pastāv iespēja, ka iegūtajiem diferenciāli ekspresētajiem gēniem un to produktu proteīnu-proteīnu mijiedarbību tīklu struktūrām ir augstā diagnostiskā un/vai prognostiskā vērtība, kas varētu palīdzēt cīņā ar vēža rezistenci pret terapiju.
Pētnieciskā darba gaitās ievērojami palīdz LU fonda administrētā doktorantūras stipendija eksakto, medicīnas, dabaszinātņu un dzīvības zinātņu jomā. Stipendijas sniegtais finansiālais atbalsts dod jaunajai pētniecei plašas iespējas kvalifikācijas celšanai. Piemēram, ar mērķi izmantot iegūtās zināšanas TCGA vēža datu pētījumā jaunā zinātniece pieteikusies sistēmu bioloģijas tiešsaistes kursiem, ko “Coursera” platformā piedāvā universitāte “Icahn School of Medicine at Mount Sinai”, savukārt pērnā gada vasarā viņa apguvusi EMBL-EBI vēža genomikas kursu. Stipendija arī kalpo kā pastāvīgs pozitīvas motivācijas avots, paaugstinot produktivitāti (kopš stipendijas piešķiršanas zinātniece kļuvusi par līdzautori 3 nopublicētiem zinātniskiem rakstiem). Viņa uzskata – atbalsts Latvijas jaunajiem pētniekiem ir ārkārtīgi svarīgs, jo degsme un radošums, kas tik nepieciešami zinātnei, stipri cieš, jaunajiem cilvēkiem saskaroties ar grūtībām, ko izraisa pietiekama atbalsta trūkums, piemēram, nepieciešamība savienot studijas doktorantūrā ar darbu pilnīgi citā jomā.
______________
Par Latvijas Universitātes fondu
Jau kopš 2004. gada Latvijas Universitātes fonds nodrošina iespēju mecenātiem un sadarbības partneriem atbalstīt gan LU, gan citas vadošās Latvijas augstskolas, tā investējot Latvijas nākotnē. LU fonda prioritātes ir atbalstīt izcilākos studentus un pētniekus, veicināt modernas mācību vides izveidi, kā arī universitātes ēku būvi un rekonstrukciju.

 CONFERENCE
CONFERENCE